Olá pessoal! Tudo bem? Sou a professora Débora Juliani, farmacêutica, especialista em Análises Clínicas e faço parte do time de professores do Gran Cursos Saúde.
Hoje vamos falar de Parasitologia, mais especificamente do diagnóstico parasitológico, que consiste na identificação direta do parasito em tecidos ou secreções de indivíduos infectados.
Claro que você já sabe que também existem diversos métodos imunológicos e moleculares que tornam possível o diagnóstico indireto de doenças parasitárias, por meio da detecção de antígenos ou material nucleico do parasito, ou ainda de respostas específicas do hospedeiro (humorais ou celulares). Porém é fato que a visualização direta dos parasitos permanece como recurso essencial para o diagnóstico de determinadas infecções, em especial em regiões mais isoladas do país e com menos recursos tecnológicos.
Fato é que este tema se torna complexo, uma vez que são inúmeros os métodos diagnósticos em Parasitologia. Eles podem ter ou não o auxílio de métodos de concentração, isolamento ou cultivo, por exemplo, e é aí que o concurseiro “se enrola” na hora da prova. Bom, vamos simplificar juntos esse assunto? Prometo que você vai compreender melhor da forma que vamos esquematizar!
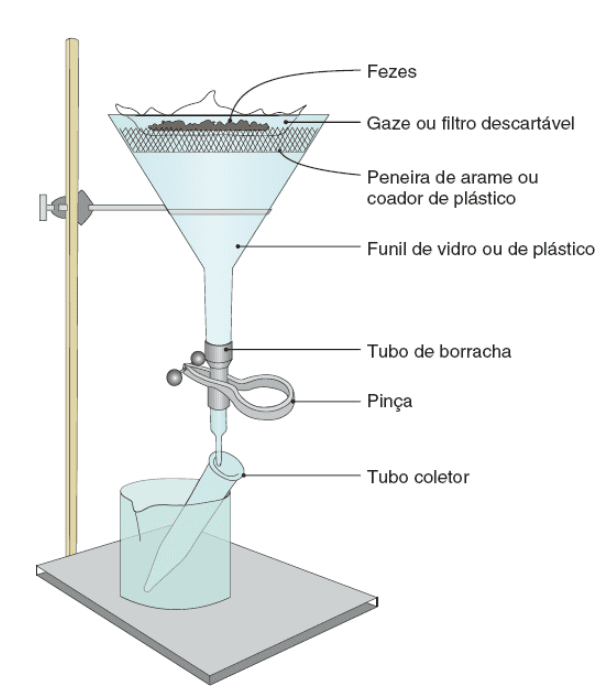
- Exame direto a fresco: é o método mais simples, em que uma pequena porção de fezes recém-eliminadas é colocada sobre uma lâmina e emulsificada em solução salina. Ao microscópio, se pode verificar a motilidade de trofozoítos e de flagelados intestinais em amostras com consistência pastosa ou líquida, por exemplo! Pode-se ainda corar o material com lugol ou azul de metileno para melhor análise de características morfológicas de cistos de protozoários, porém às custas da perda da mobilidade dos trofozoítos.
- Técnicas de concentração: possibilitam a detecção de elementos parasitários que podem não ser detectados ao exame direto a fresco do esfregaço, se valendo das propriedades físicas dos elementos parasitários, como sua massa e seu tamanho. Assim, aumenta a sensibilidade diagnóstica em relação ao exame direto, separando os elementos parasitários dos demais interferentes nas fezes com o emprego de etapas adicionais, como sedimentação, flutuação e centrifugação.
A. Método HPJ: técnica de concentração mais frequentemente empregada na rotina clínica, que consiste na sedimentação, por ação da gravidade, de uma suspensão de fezes (proporção aproximada de 2 g dissolvidos em 250 mℓ de água). Em 2 horas, a maioria dos cistos de protozoários terá sedimentado. O sedimento é, então, recolhido com uma pipeta Pasteur e examinado ao microscópio após coloração com solução de lugol.
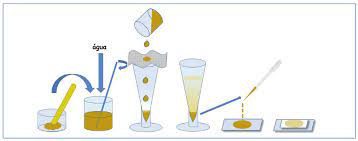
B. Método de Faust: consiste na centrifugação de uma suspensão de fezes em água (proporção de 1:10), seguida de ressuspensão e centrifugação do sedimento em uma solução saturada de sulfato de zinco (mais densa que a água), que faz com que os ovos de helmintos e cistos de protozoários tendam a se concentrar na película superficial do sobrenadante e possam ser recolhidos com o uso de uma alça bacteriológica. As amostras assim obtidas são coradas com solução de lugol e examinadas ao microscópio

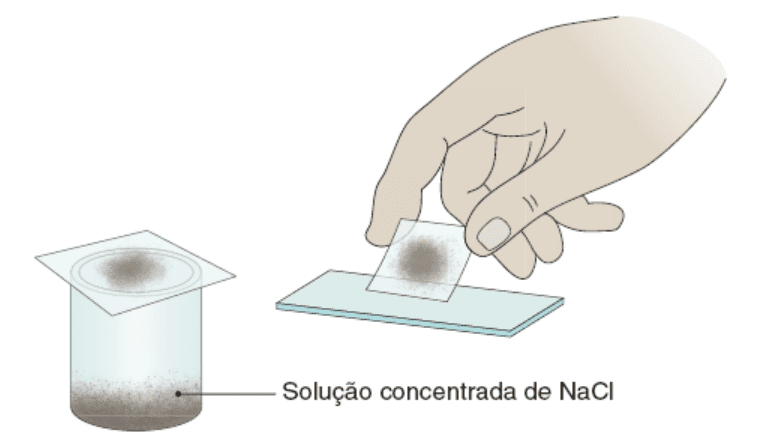
C. Método de Willis: consiste em dissolver pequenas amostras de fezes (cerca de 1 g) em solução saturada de cloreto de sódio (mais densa que a água), que faz com que os ovos de helmintos e cistos de protozoários passem pelo processo de flutuação. A solução é transferida para um recipiente de modo que a superfície do líquido atinja a borda do recipiente. Para a recuperação dos ovos e cistos, mantém-se uma lâmina de microscopia sobre a boca do recipiente, em contato com o menisco do líquido. A amostra aderida à lâmina, coberta com uma lamínula, é examinada em seguida, sem coloração.
- Técnica de migração (Baerman-Morais): ideal para a pesquisa de larvas de helmintos, especialmente de ancilostomídeos e Strongyloides stercoralis, em amostras fecais frescas. Consiste em atrair as larvas contidas na amostra fecal para o fundo de um recipiente com água aquecida, valendo-se de seu hidrotropismo (atração pela água) e termotropismo (atração pelo calor). O material, colhido em um vidro de relógio ou tubo cônico e corado com solução de lugol, é examinado ao microscópio.
- Método quantitative (Kato-Katz): baseia-se na definição de determinada massa da amostra fecal a ser examinada, seguida da contagem dos ovos nela encontrados. Os resultados são normalmente expressos em número de ovos por grama de fezes. Normalmente ocorre a passagem da amostra fecal por uma malha metálica ou de náilon, para a retirada de detritus, seguido do uso de verde malaquita para a coloração de fundo da amostra.

Gostou deste resumão? Espero que sim! Vamos ficando por aqui, mas você precisa continuar a se preparar com o time Gran Saúde para os concursos e residências que não param de surgir.
Um forte abraço e bons estudos!
![[JANELA DE OURO] R$ 54,90 – Cabeçalho](https://blog-static.infra.grancursosonline.com.br/wp-content/uploads/2026/02/09091020/janela-ouro-preco-promo-cabecalho.webp)

![[JANELA DE OURO] R$ 54,90 – Post](https://blog-static.infra.grancursosonline.com.br/wp-content/uploads/2026/02/09091401/janela-ouro-preco-promo-post.webp)